先声再明:化疗骨髓保护药物曲拉西利获得国家药监局常规批准
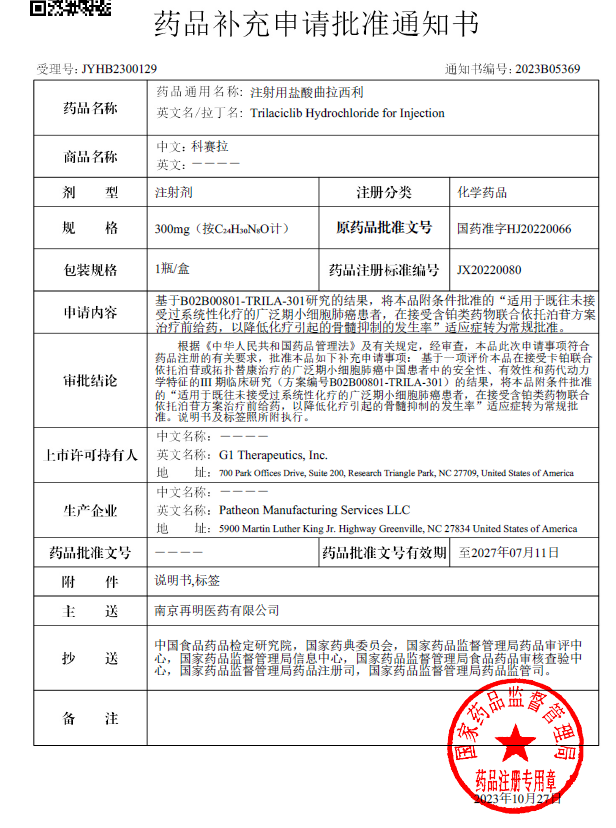
海财经·证券导报10月31日讯(记者 郭静瑜)10月30日,国家药品监督管理局(NMPA)通过审评审批,同意注射用盐酸曲拉西利用于广泛期小细胞肺癌化疗前给药的首个适应症从附条件批准转为常规批准。
据全球癌症统计数据(GLOBOCAN)报告,肺癌是中国第一大恶性肿瘤。2022年中国新发肺癌病例约87.1万,新增肺癌死亡病例约76.7万。小细胞肺癌是肺癌中恶性程度高,进展最快的亚型。广泛期小细胞肺癌五年生存率仅有2%,且可用的治疗手段有限,化疗为此类疾病的基石疗法。然而,化疗本质上是一种细胞毒药,杀死癌细胞的同时也会伤害分裂较快的健康细胞,化疗诱导的骨髓造血功能抑制是肿瘤治疗中最常见的不良反应,可增加患者感染、出血风险,降低患者免疫功能,降低患者生活质量,甚至危及生命,同时也增加了患者的经济负担。
注射用盐酸曲拉西利®(科赛拉)是先声药业与G1 Therapeutics合作开发的在化疗前给药、拥有全系骨髓保护作用的全球创新药,由先声药业集团旗下的先声再明医药负责在大中华地区所有适应症开发与商业化推广。作为一款曾获美国FDA“突破性疗法”认定,同类首创机制(First-in-Class)的短效、可逆性细胞周期蛋白依赖性激酶CDK4/6抑制剂,曲拉西利在化疗前给药,可使骨髓造血干/祖细胞暂时阻滞在G1期,免受化疗药物的杀伤,如同为骨髓造血干细胞穿上了一层“防弹衣”,让化疗减毒增效。
为加快临床亟需药物来到中国,曲拉西利在开展中国注册III期临床研究的同时,于2021年6月落地博鳌乐城医疗先行区博鳌恒大医院,作为境外已上市国内未上市新特药首次用于中国小细胞肺癌化疗患者治疗。2021年8月至2022年4月,曲拉西利启动了由海南省人民医院陈永倖教授牵头的海南真实世界研究,相关真实世界证据支持产品临床评价,进一步加快了创新药的注册进度。
2022年7月,曲拉西利通过国家药品监督管理局优先审评,获批在中国附条件上市,用于广泛期小细胞肺癌患者化疗前给药,以降低化疗引起的骨髓抑制的发生率。曲拉西利也是自乐城真实世界数据应用试点启动以来,利用这条‘快车道’在我国获批的第三款创新药。2016年到2020年进口新药在中国上市相比美国的滞后时间中位数为2.7年,而通过海南真实世界数据的助力加速,曲拉西利中美获批时间差仅1年零五个月。
附条件批准极大加速了临床急需创新药物上市的步伐,但也对已获批产品后续及时完善临床研究,取得更充足的安全、有效性数据提出了“条件”。在中国临床研究者的全力推进下,曲拉西利中国注册III期临床(TRACES)研究加速完成全部患者随访与数据分析,并于2023年1月向NMPA提交了完整的疗效与安全性数据。NMPA药品审评中心根据《中华人民共和国药品管理办法》及有关规定审查后认为,曲拉西利的研究数据满足药品注册常规批准的有关要求,同意注射用盐酸曲拉西利的首个适应症由附条件批准转为常规批准。
与此同时,曲拉西利在海南正在探索“前区后厂模式”,生产场地变更的补充申请已获得国家药监局受理,未来将有望将商业供货地由境外转移至海南海口高新区,成为中国患者更加可及的国产创新药。
目前,曲拉西利已进入《中华医学会肺癌临床诊疗指南2023版》《CSCO小细胞肺癌诊疗指南》《NCCN 小细胞肺癌临床实践指南》《NCCN 造血生长因子指南》《小细胞肺癌的全身性治疗: ASCO -Antario健康指南》等国内外多项权威临床指南。除小细胞肺癌外,该药物正在全球开展三阴性乳腺癌、膀胱癌、非小细胞肺癌等领域联合化疗及ADC药物的临床研究,为守护更广泛肿瘤患者持续探索。